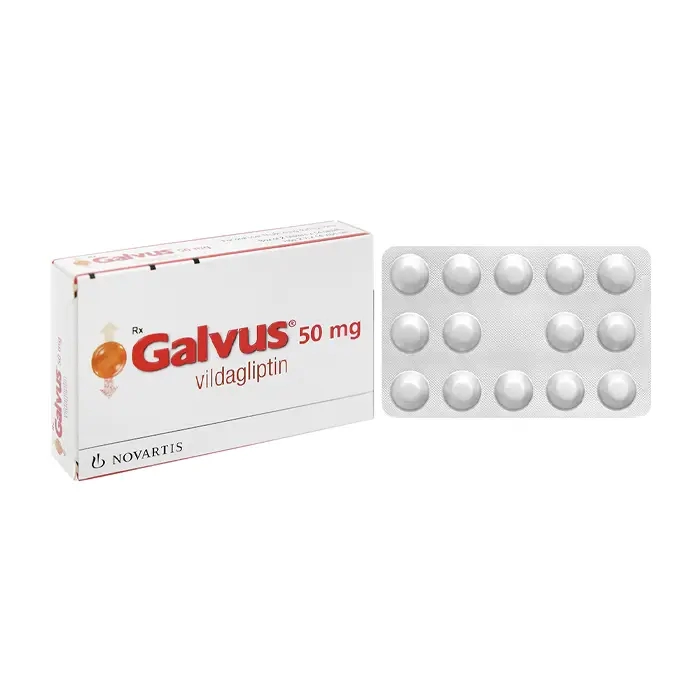
Galvus 50mg Novartis, Hộp 2 vỉ x 14 viên
* Hình sản phẩm có thể thay đổi theo thời gian
** Giá sản phẩm có thể thay đổi tuỳ thời điểm
30 ngày trả hàng Xem thêm

Số đăng ký: 840110412723
Cách tra cứu số đăng ký thuốc được cấp phép- Quy cách
- Viên
- Hộp 28 viên
Tìm thuốc Vildagliptin khác
Tìm thuốc cùng thương hiệu Novartis khác
Thuốc này được bán theo đơn của bác sĩ
Gửi đơn thuốcRevolade 25mg Novartis 4 vỉ x 7 viên - Trị xuất huyết giảm tiểu cầu miễn dịch
Thông tin sản phẩm
| Số đăng ký: | 840110412723 |
| Hoạt chất: | |
| Quy cách đóng gói: | |
| Thương hiệu: | |
| Xuất xứ: | |
| Thuốc cần kê toa: | |
| Dạng bào chế: | |
| Hàm Lượng: | |
| Nhà sản xuất: | |
| Tiêu chuẩn: |
Nội dung sản phẩm
Thành phần
- Vildagliptin: 50mg
Công dụng (Chỉ định)
Galvus được chỉ định như một thuốc hỗ trợ cho chế độ ăn và luyện tập để cải thiện sự kiểm soát đường huyết ở bệnh nhân đái tháo đường type 2 (T2DM).
Đơn trị liệu cho bệnh nhân không kiểm soát đầy đủ bằng chế độ ăn và tập luyện đơn thuần và không thể sử dụng metformin do có những chống chỉ định hoặc không dung nạp.
Trong phối hợp hai loại thuốc:
- metformin ở bệnh nhân không kiểm soát đầy đủ đường huyết khi dùng metformin đơn trị liệu ở liều tối đa dung nạp.
- với một sulfonylurea (SU) khi chế độ ăn, luyện tập và SU đơn độc không đem lại sự kiểm soát đường huyết đầy đủ.
- với một thiazolidinedione (TZD) khi chế độ ăn, luyện tập và thiazolidinedione không đem lại sự kiểm soát đường huyết đầy đủ.
- Trong phối hợp ba loại thuốc: Với một sulfonylurea và metformin khi chế độ ăn, luyện tập và điều trị kép bằng những thuốc này không đem lại sự kiểm soát đường huyết đầy đủ.
- Galvus cũng được chỉ định phối hợp với insulin (có hoặc không có metformin) khi chế độ ăn, luyện tập và liều insulin ổn định không đem lại sự kiểm soát đường huyết đầy đủ.
Liều dùng
Kiểm soát việc điều trị đái tháo đường nên tùy theo từng bệnh nhân.
Liều được khuyến cáo của Galvus là 50mg một hoặc hai lần mỗi ngày.
Trong đơn trị liệu, và trong điều trị phối hợp với Metformin, với một TZD hoặc với insulin (có hoặc không có Metformin), liều được khuyến cáo của Galvus là 50mg hoặc 100mg mỗi ngày.
Trong điều trị phối hợp hai loại thuốc với một sulfonylurea, liều được khuyến cáo của Vildagliptin là 50mg một lần một ngày. Ở nhóm bệnh nhân này, vildagliptin 100mg/ngày không hiệu quả hơn vildagliptin 50mg, 1 lần/ngày.
Trong điều trị phối hợp 3 loại thuốc với metformin và một SU, liều được khuyến cáo của Galvus là 100mg mỗi ngày.
Nếu sự kiểm soát đường huyết chặt chẽ hơn cần đến liều dùng trên liều vildagliptin tối đa hàng ngày được khuyến cáo, có thể xem xét bổ sung các thuốc điều trị đái tháo đường khác như metformin, một sulfonylurea, một thiazolidinedione hoặc insulin.
Liều lớn hơn 100mg không được khuyến cáo.
Độ an toàn và hiệu quả của vildagliptin trong phác đồ phối hợp ba thuốc đường uống với metformin và một dẫn chất thiazolidinedione chưa được thiết lập.
Nhóm bệnh nhân mục tiêu: Người lớn từ 18 tuổi trở lên.
Nhóm bệnh nhân đặc biệt:
- Suy thận: Không cần điều chỉnh liều Galvus ở bệnh nhân suy thận nhẹ. Ở bệnh nhân suy thận trung bình hoặc nặng hoặc bệnh thận giai đoạn cuối (ESRD), liều Galvus được khuyến cáo là 50mg, 1 lần/ngày
- Suy gan: Không khuyến cáo dùng Galvus cho bệnh nhân suy gan, kể cả bệnh nhân có ALT hoặc AST trước điều trị > 2,5 lần giới hạn trên của mức bình thường
- Bệnh nhân cao tuổi: Ở những bệnh nhân ≥ 65 tuổi và ≥ 75 tuổi được điều trị bằng Galvus, không quan sát thấy sự khác biệt về độ an toàn tổng thể, sự dung nạp hoặc hiệu quả giữa nhóm bệnh nhân cao tuổi này với những bệnh nhân trẻ tuổi hơn. Do đó không cần điều chỉnh liều trên bệnh nhân cao tuổi.
- Bệnh nhân trẻ em: Galvus chưa được nghiên cứu ở bệnh nhân dưới 18 tuổi, do đó không khuyến cáo dùng Galvus cho bệnh nhân trẻ em.
Cách dùng
- Dùng đường uống.
- Galvus có thể dùng cùng hoặc không cùng thức ăn
- Liều 50mg nên được uống một lần một ngày vào buổi sáng. Liều 100mg nên được chia thành 2 liều 50mg, uống vào buổi sáng và buổi tối.
- Nếu bỏ lỡ một liều Galvus, cần uống ngay khi bệnh nhân nhớ ra. Không nên uống một liều gấp đôi trong cùng một ngày.
Quá liều
Dấu hiệu và triệu chứng:
- Ở những người khỏe mạnh (7 – 14 người mỗi nhóm điều trị), Vildagliptin được dùng ở các liều 25, 50, 100, 200, 400 và 600mg, 1 lần/ngày trong 10 ngày liên tiếp. Các liều đến 200mg đã được dung nạp tốt. Ở liều 400mg, có 3 trường hợp đau cơ, các trường hợp riêng lẻ về dị cảm nhẹ và thoáng qua, sốt, phù và tăng thoáng qua về nồng độ lipase (gấp 2 lần giới hạn trên của mức bình thường), ở liều 600mg, một người bị phù bàn chân và bàn tay và nồng độ creatine phosphokinase (CPK) tăng cao, kèm theo tăng aspartate aminotransferase (AST), protein phản ứng C (CRP) và myoglobin. Thêm ba người ở nhóm liều này có biểu hiện phù cả hai bàn chân, kèm theo dị cảm ở 2 trường hợp. Tất cả các triệu chứng và bất thường về xét nghiệm mất đi sau khi ngừng thuốc nghiên cứu.
Xử trí:
- Vildagliptin không thể được loại bỏ bằng thẩm tách, tuy nhiên chất chuyển hóa chính do thủy phân (LAY151) có thể loại bỏ bằng thẩm tách máu.
Không sử dụng trong trường hợp sau (Chống chỉ định)
- Chống chỉ định dùng Galvus cho bệnh nhân đã biết bị quá mẫn với vildagliptin hoặc với bất cứ tá dược nào của thuốc.
Tác dụng không mong muốn (Tác dụng phụ)
Dữ liệu an toàn thu được từ tổng số 3.784 bệnh nhân dùng vildagliptin với liều hằng ngày 50 mg (1 lần/ngày) hoặc 100 mg (50 mg, 2 lần/ngày hoặc 100 mg, 1 lần/ngày) ở các thử nghiệm có đối chứng trong thời gian ít nhất 12 tuần. Trong số những bệnh nhân này, có 2.264 bệnh nhân dùng vildagliptin đơn trị liệu và 1.520 bệnh nhân dùng vildagliptin phối hợp với một thuốc khác. 2.682 bệnh nhân được điều trị bằng vildagliptin 100 mg/ngày (50 mg, 2 lần/ngày hoặc 100 mg, 1 lần/ngày) và 1.102 bệnh nhân được điều trị bằng vildagliptin 50 mg, 1 lần/ngày.
Đa số các phản ứng bất lợi trong những thử nghiệm này là nhẹ và thoáng qua, không cần phải ngừng điều trị. Không có sự liên quan giữa những phản ứng bất lợi này với tuổi, chủng tộc, thời gian dùng thuốc hoặc liều lượng hàng ngày.
Các trường hợp hiếm gặp về rối loạn chức năng gan (kể cả viêm gan) đã được báo cáo. Trong những trường hợp này, bệnh nhân thường không có triệu chứng, không có di chứng lâm sàng và các xét nghiệm chức năng gan trở về bình thường sau khi ngừng điều trị. Trong các dữ liệu của các thử nghiệm đơn trị liệu và điều trị bổ trợ có đối chứng trong thời gian đến 24 tuần, tỷ lệ tăng ALT hoặc AST ≥ 3 lần giới hạn trên của mức bình thường (ULN) (theo phân loại hiện nay dựa vào ít nhất 2 lần đo liên tiếp hoặc lúc thăm khám cuối cùng trong quá trình điều trị) là 0,2% đối với vildagliptin 50 mg, 1 lần/ngày, 0,3% đối với vildagliptin 50 mg, 2 lần/ngày và 0,2% đối với tất cả các thuốc so sánh. Sự tăng các transaminase này thường không có triệu chứng, về bản chất không tiến triển và không đi kèm với ứ mật hoặc vàng da.
Những trường hợp phù mạch hiếm gặp đã được báo cáo khi dùng vildagliptin với một tỷ lệ tương tự như ở nhóm đối chứng. Tỷ lệ cao hơn về các trường hợp này đã được báo cáo khi dùng vildagliptin phối hợp với thuốc ức chế enzyme chuyển angiotensin (thuốc ức chế ACE). Đa số các trường hợp đều ở mức độ nhẹ và qua đi khi tiếp tục điều trị bằng vildagliptin.
Bảng danh sách các phản ứng bất lợi: Các phản ứng bất lợi đã được báo cáo ở bệnh nhân dùng Galvus trong các nghiên cứu mù đôi dưới dạng đơn trị liệu và điều trị bổ trợ được liệt kê dưới đây, đối với mỗi chỉ định, theo nhóm hệ cơ quan và tần suất tuyệt đối. Các tần suất được quy ước là: rất thường gặp (≥ 1/10); thường gặp (≥ 1/100 đến < 1/10); ít gặp (≥ 1/1.000 đến < 1/100); hiếm gặp (≥ 1/10.000 đến < 1/1.000); rất hiếm gặp (< 1/10.000), không rõ (không thể ước tính từ các dữ liệu hiện có). Trong mỗi nhóm tần suất, các phản ứng bất lợi được trình bày theo thứ tự mức độ nghiêm trọng giảm dần.
Phối hợp với metformin:
Xem bảng 2:

Mô tả các phản ứng bất lợi chọn lọc: Trong các thử nghiệm lâm sàng có đối chứng phối hợp vildagliptin 100 mg/ngày + metformin, không có báo cáo bệnh nhân ngừng thuốc do phản ứng bất lợi ở nhóm điều trị bằng vildagliptin 100 mg/ngày + metformin hoặc giả dược + metformin.
Trong các thử nghiệm lâm sàng, tỷ lệ hạ đường huyết thường gặp ở bệnh nhân dùng vildagliptin 100 mg/ngày phối hợp với metformin (1%) và ít gặp ở bệnh nhân dùng giả dược + metformin (0,4%). Không có các trường hợp hạ đường huyết nặng được báo cáo ở nhóm bệnh nhân dùng vildagliptin.
Trong các thử nghiệm lâm sàng, cân nặng không thay đổi so với ban đầu khi dùng vildagliptin 100 mg/ngày cộng với metformin (+0,2kg đối với vildagliptin và -1,0kg đối với giả dược).
Các thử nghiệm lâm sàng trong thời gian lên đến hơn 2 năm không cho thấy bất kỳ dấu hiệu nào thêm về tính an toàn hoặc các nguy cơ không biết trước nào khi vildagliptin được dùng bổ trợ cho metformin.
Phối hợp với một sulphonylurea:
Xem bảng 3:

Mô tả các phản ứng bất lợi chọn lọc: Trong các thử nghiệm lâm sàng có đối chứng phối hợp vildagliptin 50 mg + sulphonylurea, tỷ lệ chung về ngừng thuốc do phản ứng bất lợi là 0,6% ở nhóm điều trị bằng vildagliptin 50 mg + sulphonylurea so với 0% ở nhóm dùng giả dược + sulphonylurea.
Trong các thử nghiệm lâm sàng, tỷ lệ hạ đường huyết ở nhóm dùng vildagliptin 50 mg, 1 lần/ngày cộng với glimepiride là 1,2% so với 0,6% ở nhóm dùng giả dược + glimepiride. Không có các trường hợp hạ đường huyết nặng được báo cáo ở nhóm dùng vildagliptin.
Trong các thử nghiệm lâm sàng, cân nặng không thay đổi so với ban đầu khi dùng vildagliptin 50 mg/ngày cộng với glimepiride (-0,1kg đối với vildagliptin và -0,4kg đối với giả dược).
Phối hợp với một thiazolidinedione:
Xem bảng 4:

Mô tả các phản ứng bất lợi chọn lọc: Trong các thử nghiệm lâm sàng có đối chứng phối hợp vildagliptin 100 mg/ngày với một thiazolidinedione, không có báo cáo bệnh nhân ngừng thuốc do phản ứng bất lợi ở nhóm điều trị bằng vildagliptin 100 mg/ngày + thiazolidinedione hoặc giả dược + thiazolidinedione.
Trong các thử nghiệm lâm sàng, tỷ lệ hạ đường huyết ít gặp ở nhóm bệnh nhân dùng vildagliptin + pioglitazone (0,6%) nhưng thường gặp ở nhóm bệnh nhân dùng giả dược + pioglitazone (1,9%). Không có các trường hợp hạ đường huyết nặng được báo cáo ở nhóm bệnh nhân dùng vildagliptin.
Trong nghiên cứu bổ trợ cho pioglitazone, sự tăng cân nặng tuyệt đối với giả dược là 1,4kg và với Galvus 100 mg/ngày là 2,7kg.
Tỷ lệ phù ngoại biên khi dùng vildagliptin 100 mg/ngày cộng với liều tối đa của pioglitazone nền (45 mg, 1 lần/ngày) là 7% so với 2,5% đối với pioglitazone nền đơn độc.
Đơn trị liệu:
Xem bảng 5:

Mô tả các phản ứng bất lợi chọn lọc: Ngoài ra, trong các thử nghiệm đơn trị liệu có đối chứng với vildagliptin, tỷ lệ chung về ngừng thuốc do các phản ứng bất lợi không cao hơn đối với bệnh nhân được điều trị bằng vildagliptin với liều 100 mg/ngày (0,3%) so với giả dược (0,6%) hoặc thuốc so sánh (0,5%).
Trong các nghiên cứu đơn trị liệu so sánh có đối chứng, hạ đường huyết được báo cáo ít gặp ở 0,4% bệnh nhân (7 trong số 1.855) được điều trị bằng vildagliptin 100 mg/ngày so với 0,2% bệnh nhân (2 trong số 1.082) ở nhóm được điều trị bằng một chất so sánh là hoạt chất thuốc hoặc giả dược và không có trường hợp nào nặng hoặc nghiêm trọng được báo cáo.
Trong các thử nghiệm lâm sàng, cân nặng không thay đổi so với ban đầu khi dùng vildagliptin 100 mg/ngày dưới dạng đơn trị liệu (-0,3kg đối với vildagliptin và -1,3kg đối với giả dược).
Các thử nghiệm lâm sàng trong thời gian đến 2 năm không cho thấy bất kỳ dấu hiệu nào thêm về tính an toàn hoặc các nguy cơ không biết trước nào khi dùng vildagliptin đơn trị liệu.
Phối hợp với metformin và một sulphonylurea:
Xem bảng 6:

Mô tả các phản ứng bất lợi chọn lọc: Không có báo cáo về ngừng thuốc do các phản ứng bất lợi ở nhóm điều trị bằng vildagliptin + metformin + glimepiride so với 0,6% ở nhóm điều trị bằng giả dược + metformin + glimepiride.
Tỷ lệ hạ đường huyết thường gặp ở cả hai nhóm điều trị (5,1% đối với nhóm điều trị bằng vildagliptin + metformin + glimepiride so với 1,9% đối với nhóm điều trị bằng giả dược + metformin + glimepiride). Một trường hợp hạ đường huyết nặng đã được báo cáo ở nhóm dùng vildagliptin.
Vào cuối cuộc nghiên cứu, ảnh hưởng trên thể trọng trung bình là trung tính (+ 0,6kg ở nhóm dùng vildagliptin và -0,1kg ở nhóm dùng giả dược).
Phối hợp với insulin:
Xem bảng 7:

Mô tả các phản ứng bất lợi chọn lọc: Trong các thử nghiệm lâm sàng có đối chứng sử dụng vildagliptin 50 mg, 2 lần/ngày phối hợp với insulin, có hoặc không có metformin dùng đồng thời, tỷ lệ chung về ngừng thuốc do các phản ứng phụ là 0,3% ở nhóm điều trị bằng vildagliptin và không có trường hợp ngừng thuốc ở nhóm giả dược.
Tỷ lệ hạ đường huyết tương tự ở cả hai nhóm điều trị (14% ở nhóm dùng vildagliptin so với 16,4% ở nhóm dùng giả dược). Hai bệnh nhân báo cáo có phản ứng hạ đường huyết nặng ở nhóm dùng vildagliptin và 6 bệnh nhân ở nhóm dùng giả dược.
Vào cuối cuộc nghiên cứu, ảnh hưởng trên thể trọng trung bình là trung tính (thay đổi +0,6kg so với ban đầu ở nhóm dùng vildagliptin và không thay đổi cân nặng ở nhóm dùng giả dược).
Kinh nghiệm hậu mãi:
Xem bảng 8:

Báo cáo về các phản ứng bất lợi nghi ngờ: Việc báo cáo các phản ứng bất lợi nghi ngờ sau khi được cấp giấy phép lưu hành sản phẩm là quan trọng. Điều này cho phép theo dõi liên tục cân bằng giữa lợi ích và nguy cơ của thuốc.
Thông báo cho bác sĩ những tác dụng không mong muốn gặp phải khi sử dụng thuốc.
Tương tác với các thuốc khác
- Vildagliptin có khả năng tương tác thuốc yếu. Vì vildagliptin không phải là một cơ chất của enzyme cytochrom P (CYP) 450, không ức chế và cũng không gây cảm ứng các enzyme CYP 450 nên không có khả năng tương tác với các thuốc dùng đồng thời là cơ chất, chất ức chế hoặc chất gây cảm ứng các enzyme này.
- Hơn nữa, vildagliptin không ảnh hưởng đến độ thanh thải chuyển hóa của các thuốc dùng đồng thời được chuyển hóa bởi CYP 1A2, CYP 2C8, CYP 2C9, CYP 2C19, CYP 2D6, CYP 2E1 và CYP 3A4/5. Các nghiên cứu về tương tác thuốc-thuốc đã được tiến hành với các thuốc thường được kê đơn đồng thời cho bệnh nhân đái tháo đường type 2 hoặc những thuốc có cửa sổ điều trị hẹp. Kết quả của những nghiên cứu này cho thấy không có tương tác nào có ý nghĩa lâm sàng với các thuốc điều trị đái tháo đường dạng uống khác (glibenclamide, pioglitazone, metformin), amlodipine, digoxin, ramipril, simvastatin, valsartan hoặc warfarin sau khi dùng đồng thời với vildagliptin.
Lưu ý khi sử dụng (Cảnh báo và thận trọng)
Thuốc này chỉ dùng theo sự kê đơn của thầy thuốc.
- Tổng quát: Galvus không phải là một chất thay thế insulin trên bệnh nhân cần insulin. Không được dùng Galvus cho bệnh nhân đái tháo đường type 1 hoặc để điều trị nhiễm toan ceton do đái tháo đường.
- Suy gan: Không khuyến cáo dùng Galvus cho bệnh nhân suy gan, kể cả bệnh nhân có ALT hoặc AST trước điều trị > 2,5 lần giới hạn trên của mức bình thường.
- Theo dõi enzyme gan: Các trường hợp hiếm gặp về rối loạn chức năng gan (kể cả viêm gan) đã được báo cáo. Trong những trường hợp này, bệnh nhân thường không có triệu chứng, không có di chứng lâm sàng và các xét nghiệm chức năng gan trở về bình thường sau khi ngừng điều trị. Cần thực hiện các xét nghiệm chức năng gan trước khi bắt đầu điều trị bằng Galvus. Cần theo dõi các xét nghiệm chức năng gan trong khi điều trị bằng Galvus 3 tháng một lần trong năm đầu và định kỳ sau đó. Những bệnh nhân bị tăng nồng độ transaminase cần được theo dõi bằng cách đánh giá lại chức năng gan lần thứ hai để khẳng định kết quả và sau đó phải thường xuyên xét nghiệm chức năng gan cho đến khi các trị số bất thường trở về nồng độ bình thường. Nếu AST hoặc ALT tăng gấp 3 lần giới hạn trên của mức bình thường hoặc cao hơn và kéo dài, khuyến cáo ngừng điều trị bằng Galvus. Nếu bệnh nhân bị vàng da hoặc có các biểu hiện khác cho thấy rối loạn chức năng gan, phải ngừng dùng Galvus và liên hệ với bác sĩ ngay. Sau khi ngừng điều trị bằng Galvus và các xét nghiệm chức năng gan đã trở về bình thường, không được dùng lại vildagliptin.
- Suy tim: Một thử nghiệm lâm sàng với Vildagliptin trên bệnh nhân có phân độ suy tim theo Hiệp hội tim New York (NYHA) từ I-III cho thấy điều trị với Vildagliptin không liên quan đến sự thay đổi chức năng thất trái hoặc làm nặng thêm tình trạng suy tim sung huyết (CHF) trước đó, so với giả dược. Kinh nghiệm lâm sàng trên những bệnh nhân có suy tim độ III theo NYHA được điều trị với Vildagliptin còn hạn chế và kết quả là không kết luận được (xem phần Các nghiên cứu lâm sàng).
- Không có kinh nghiệm về việc sử dụng vildagliptin trong các thử nghiệm lâm sàng ở bệnh nhân suy tim độ IV theo phân độ chức năng của NYHA và do đó không khuyến cáo sử dụng ở những bệnh nhân này.
- Suy thận: Kinh nghiệm còn hạn chế ở bệnh nhân bị bệnh thận giai đoạn cuối (ESRD) đang thẩm phân máu. Vì vậy cần thận trọng khi dùng Galvus ở những bệnh nhân này.
- Rối loạn da: Tổn thương da, bao gồm phồng rộp và loét đã được báo cáo ở các chi của khỉ trong các nghiên cứu độc học phi lâm sàng. Mặc dù không quan sát thấy các tổn thương da với tỷ lệ tăng trong các thử nghiệm lâm sàng, có kinh nghiệm còn hạn chế ở bệnh nhân bị biến chứng về da do đái tháo đường.
- Hơn nữa, đã có báo cáo hậu mãi về tổn thương da dạng bóng nước và tróc vảy. Vì vậy, để phù hợp với chăm sóc thường quy ở bệnh nhân đái tháo đường, khuyến cáo nên theo dõi các rối loạn da như phồng rộp hoặc loét.
- Viêm tụy cấp: Theo kinh nghiệm sau khi đưa thuốc ra thị trường, có 1 số trường hợp viêm tụy cấp được báo cáo tự phát. Bệnh nhân phải được thông báo về các triệu chứng đặc trưng của viêm tụy cấp như: đau bụng nhiều và kéo dài.
- Nếu nghi ngờ viêm tụy, phải dừng dùng vildagliptin; nếu đã xác định viêm tụy cấp thì không được điều trị vildagliptin trở lại. Cần thận trọng ở bệnh nhân có tiền sử viêm tụy cấp.
- Hạ đường huyết: Sulphonylurea đã được biết gây hạ đường huyết. Bệnh nhân đang dùng vildagliptin phối hợp với sulphonylurea có thể có nguy cơ hạ đường huyết. Vì vậy có thể xem xét dùng một liều sulphonylurea thấp hơn để làm giảm nguy cơ hạ đường huyết.
Phụ nữ mang thai và cho con bú
- Phụ nữ mang thai: Vildagliptin không gây quái thai trên cả chuột cống và thỏ. Chưa có đủ kinh nghiệm sử dụng Galvus trên phụ nữ có thai. Vì vậy không nên dùng Glavus trong thời kỳ mang thai trừ khi lợi ích mang lại cho người mẹ cao hơn nguy cơ tiềm ẩn đối với thai.
- Phụ nữ cho con bú: Vì chưa rõ có phải vildagliptin được bài tiết vào sữa mẹ hay không, do đó không nên dùng Galvus đối với phụ nữ cho con bú.
- Khả năng sinh sản: Các nghiên cứu về khả năng sinh sản được thực hiện trên chuột ở các liều gấp 200 lần liều dùng ở người đã cho thấy không có bằng chứng về suy giảm khả năng sinh sản hay phát triển phôi sớm do Vildagliptin. Chưa có nghiên cứu về ảnh hưởng trên khả năng sinh sản ở người được thực hiện với Galvus.
Người lái xe và vận hành máy móc
- Chưa có nghiên cứu được tiến hành về tác động trên khả năng lái xe và vận hành máy móc. Vì vậy những bệnh nhân có thể bị chóng mặt nên tránh lái xe hoặc vận hành máy móc.
Bảo quản
- Nơi khô, tránh ánh sáng, nhiệt độ dưới 30°C.
Đánh Giá - Bình Luận
- Đặt đơn thuốc trong 30 phút. Gửi đơn
- Miễn phí giao hàng cho đơn hàng 700K
- Đổi trả trong 6 ngày. Chính sách đổi trả
- CSKH:
0937581984